La queratina es una proteína estructural que se encuentra en el integumento de los vertebrados. El integumento es la cobertura natural de un organismo o un órgano, como su piel, corteza, concha, o cáscara. Es, después del colágeno, el biopolímero natural más importante encontrado en los animales. Los materiales queratinizados tienen diferentes morfologías que dependen de su función. Abarcan desde capas impermeables, como el caparazón de una tortuga, hasta materiales estructuralmente robustos muy resistentes como los cuernos. La queratina es eficiente en tensión -lana- y en compresión -pezuñas-.

Las proteínas están formadas por unidades básicas llamadas aminoácidos. En la naturaleza existen numerosos aminoácidos distintos, pero sólo 20 de ellos constituyen las proteínas. Éstas pueden llegar a contener desde cientos a miles unidades de aminoácidos unidos de formas muy diferentes. Los polipéptidos son la combinación de pocas unidades de aminoácidos -hasta 10-.
Similitudes y diferencias entre la queratina y el colágeno
Existen similitudes y diferencias respecto al colágeno, la otra proteína mayoritaria de los animales. El colágeno se encuentra en los huesos, dientes y tejidos conectivos. Ambas proteínas contienen una secuencia de aminoácidos bien definida y polipéptidos con hélice alfa, es decir, plegados en el espacio en forma de hélice dextrógira. Eso es debido a que contienen grandes cantidades de dos de los aminoácidos, glicina y alanina, que son los que hacen posible esa estructura de α-hélice.
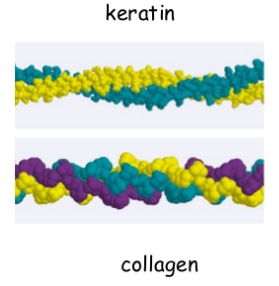
Estructuras del colágeno y la queratina
En la queratina, dos cadenas de polipéptidos -α-queratina- giran juntas formando una espiral. En el colágeno son 3 las α-hélices de polipéptidos -tropocolágeno- que giran juntas ensamblándose para formar la fibrilla de colágeno.
Una de las mayores diferencias es que los queratinocitos -células productoras de queratina- mueren después de producir la queratina. Por ello, la queratina es un tejido “muerto” no vascularizado, al contrario del colágeno que forma una matriz extracelular. Los materiales más queratinizados forman losas poligonales de decenas de micras de diámetro que se superponen lateralmente y se apilan una encima de la otra para formar una capa relativamente densa.
Otra diferencia es que la queratina puede considerarse un material compuesto que consiste en un polímero reforzado -queratina amorfa- con fibra corta -queratina cristalina-. Esta parte cristalina es insoluble en agua, pero las partes amorfas pueden absorber agua e hincharse.
Normalmente, la queratina tiene un módulo de Young mayor. Éste es una propiedad mecánica que mide la rigidez de un material sólido. Por ello tiene una tensión muy elevada a la rotura y, por lo tanto, valores altos de tenacidad.
La queratina está formada en gran proporción por el aminoácido cisteína.
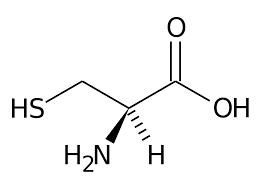
Estructura química del aminoácido cisteína
Este aminoácido contiene azufre -S- en un grupo conocido químicamente como tiol, -SH, capaz de producir enlaces covalentes, de los enlaces más fuertes entre moléculas, formando puentes disulfuro, -S-S-. Este enlace puede formarse tanto entre las cadenas de polipéptidos como uniendo otras moléculas de la matriz.
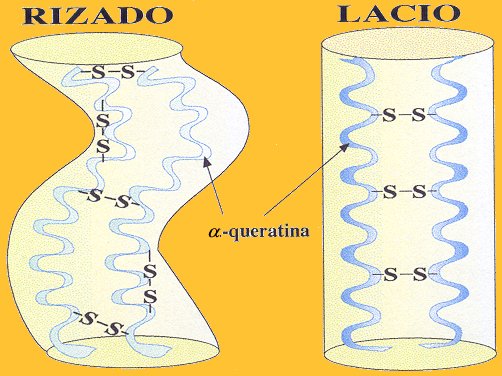
Formación de puentes disulfuro en cabellos rizados y lisos
Las queratinas pueden clasificarse como “duras” o “blandas” dependiendo de la cantidad de azufre que contienen. Las blandas contienen menos por lo que pueden formar menos entrecruzamientos entre moléculas. Este tipo de queratina se encuentra casi exclusivamente en la piel.
Estructura de las diferentes queratinas
Las macromoléculas que forman la queratina son las cadenas de polipéptidos. Estas cadenas pueden rizarse formando hélices -conformación α- o unir lado por lado en láminas plisadas -conformación β-.
Los mamíferos tienen aproximadamente 30 variantes de α-queratinas como principales constituyentes del cabello, uñas, pezuñas, cuernos, plumas y la capa epidérmica de la piel. En reptiles y pájaros, las garras, escamas, plumas y picos están formados por β-queratina, que es más resistente que la forma α, y está configurada en una disposición de hoja plegada.
Las setas del pie de geco, que proporcionan una fuerte atracción de sus pies a las superficies, están formadas por β-queratina.
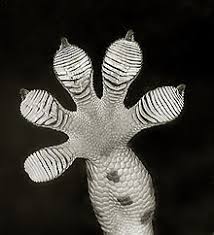
Pie de geco
Estructura de la α-queratina
La siguiente figura muestra su estructura molecular. En ella se pueden identificar tres regiones distintas: i/ Cadena de hélice α ii/ Dos polipéptidos de queratina forman una bobina enrollada iii/ Protofilamentos formados por dos filas escalonadas de bobinas enrolladas enlazadas cabeza-cola iv/ Protofilamentos que dimerizan para formar una protofibrilla, 8 de ellos forman un filamento intermedio. Estos filamentos intermedios pueden ser ácidos -tipo I- o básicos -tipo II-. Están embebidos en una matriz amorfa de queratina de dos tipos de proteínas. Altas en azufre, porque contienen más cisteína y altas en glicina-tirosina, porque contienen los respectivos residuos.
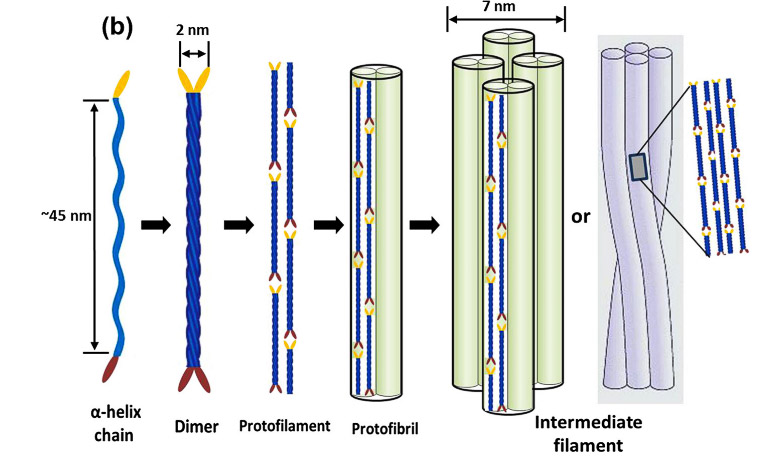
Estrucura de la alfa queratina
Las propiedades mecánicas dependen de la forma como se alinean los filamentos intermedios. Así, la fuerza de tensión de un cabello humano -200 MPa- es un orden de magnitud mayor que la de las uñas debido al mejor alineamiento de los filamentos intermedios de la queratina en el cabello.
La diferente proporción de la queratina amorfa -matriz- y la cristalina -fibras- varía de forma significativa en diferentes materiales. Por ejemplo, las fracciones volumétricas de la matriz son 0,37, 0,42 y 0,54 según se trate de púas de puercoespín, lana o cabello humano, respectivamente.
Estructura de la β-queratina
La figura siguiente es su representación en forma de hoja doblada. En este caso, las cadenas de proteínas permanecen unidas por un enlace mucho más débil que el anterior, el enlace por puentes de hidrógeno.
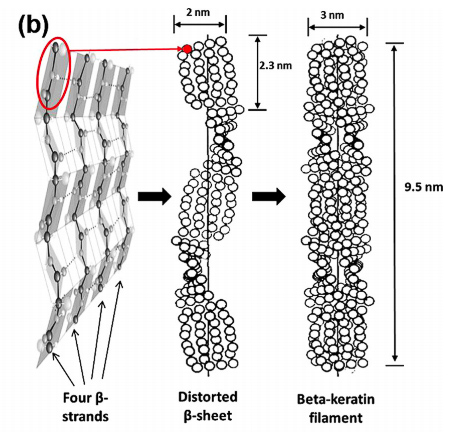
Estructura de la beta queratina
Las hojas dobladas están formadas por cadenas de proteínas antiparalelas. Estas cadenas se unen por puentes de hidrógeno. Las cadenas β enlazadas forman unas superficies planas rígidas que están ligeramente dobladas, formando una disposición de láminas plegadas. Si la forma α se estira, se transformará en la forma β, que es reversible hasta aproximadamente un 30% de deformación.
En el siguiente artículo veremos las consecuencias del deterioro de las capas de queratina.
Bibliografía
https://my.clevelandclinic.org/health/articles/10978-skin
https://www.ausmed.com/cpd/articles/what-is-keratin
https://www.sciencedirect.com/science/article/pii/S0079642515000596
http://meyersgroup.ucsd.edu/papers/journals/Meyers%20354.pdf
https://www.sciencedirect.com/science/article/pii/S0955067406001888
