
¿Qué es el equilibrio químico?
Es muy frecuente pensar que cuando tenemos dos sustancias que reaccionan entre sí, lo hacen dando lugar a unos productos y las sustancias de partida desaparecen. Sin embargo, esto en la gran mayoría de veces no es así. Las sustancias de partida, conocidas como reactivos, no reaccionan completamente sino sólo parcialmente y se establece un equilibrio entre éstas y los productos resultantes. Este proceso se suele representar de esta forma:
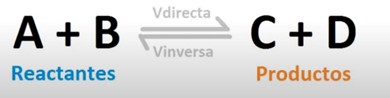
La doble flecha indica que existe un equilibrio entre las sustancias de partida, A y B en este caso, y los productos resultantes de la reacción, C y D. Esto es lo que se conoce como equilibrio químico. Y las letras minúsculas a, b c y d representan la proporción de A, B, C y D, que reaccionan. Esto es lo que se conoce como reacción reversible, va en sentido directo e inverso.
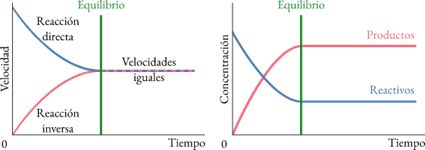
Lo que sucede, como veis en esta figura, es que la velocidad de reacción se iguala en ambos sentidos y las concentraciones de los reactivos y productos permanecen constantes.
Principio de Le Chatelier
El equilibrio químico está regido por un principio general conocido como el principio de Le Chatelier. Éste establece que, si un sistema en equilibrio se somete a un cambio de condiciones, éste se desplazará hacia una nueva posición a fin de contrarrestar el efecto que lo perturbó y recuperar el estado de equilibrio.

¿Qué es la constante de equilibrio químico?
El equilibrio químico se expresa matemáticamente mediante la siguiente ecuación:
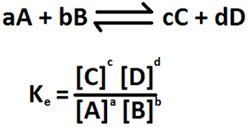
donde Ke se conoce como constante de equilibrio.
Como vemos, en el numerador están las concentraciones de productos y en el denominador las de los reactivos.
Imaginemos que nosotros añadimos, por ejemplo, una cantidad de C determinada. Como el valor de la constante tiene que mantenerse, el equilibrio se desplaza hacia la izquierda para que disminuya la concentración de C y Ke nos dé el mismo valor. Es decir, en realidad el equilibrio está contrarrestando el efecto que lo perturbó, cumpliendo así el principio de Le Chatelier.
![]()
Dependiendo de los reactivos, este equilibrio está más o menos desplazado hacia la derecha. Si A y B tienen mucha afinidad entre sí y reaccionan muy fácilmente, el equilibrio estará desplazado hacia la derecha y, a su vez, la constante de equilibrio tendrá un valor alto, mayor que 1. Si, por el contrario, A y B tienen poca tendencia a reaccionar entre sí, el equilibrio estará desplazado hacia la izquierda y la constante de equilibrio será menor que 1.
Los ácidos

De forma intuitiva todos sabemos qué es un ácido. Tienen un sabor agrio, son muy corrosivos y disueltos conducen la electricidad. Esto último sucede porque al disolverlos en agua, la molécula de ácido, inicialmente neutra, se separa en dos partes cargadas eléctricamente. Una de ellas son los protones, es decir átomos de hidrógeno que han perdido un electrón, y que por lo tanto han quedado cargados positivamente, H+. Y la otra parte de la molécula se ha llevado ese electrón y ha quedado cargada negativamente, A–. Es decir, si HA es nuestro ácido, la reacción que tiene lugar en agua es la siguiente:

Por lo tanto, de forma genérica, un ácido es toda sustancia que en agua libera protones.
Vemos que volvemos a tener un equilibrio y sabemos que según sea la naturaleza de los reactivos, el ácido y el agua en este caso, el equilibrio estará más o menos desplazado hacia la derecha, es decir, el ácido estará más o menos disociado. En estas reacciones podríamos añadir el agua, pero para simplificar no lo hacemos.
Ácidos fuertes
Si el equilibrio está muy desplazado hacia la derecha, entonces se dice que el ácido es fuerte:
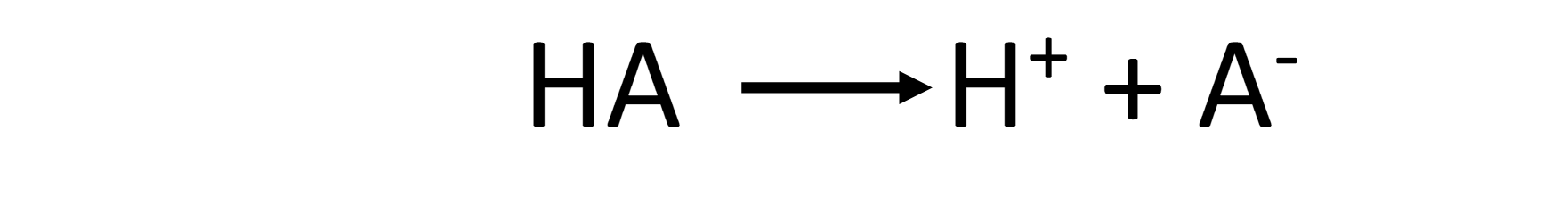
Los ácidos fuertes se disocian completamente en disoluciones acuosas, de modo que todas sus moléculas pierden al menos un protón (H+)
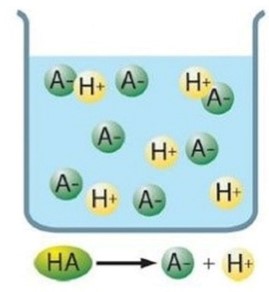
La constante de equilibrio, llamada constante de acidez, en este caso sería:
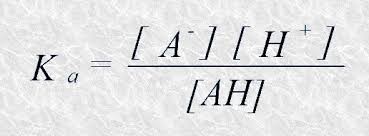
Fijaos que si el denominador es muy pequeño, Ka es muy grande. Por lo tanto Ka para los ácidos fuertes es siempre mayor que 1.
Ácidos débiles
Si el equilibrio está muy desplazado hacia la izquierda, es decir, es un ácido poco reactivo que está muy poco disociado, entonces se trata de un ácido débil:
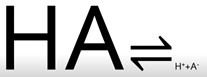
Los ácidos débiles sólo se disocian parcialmente y en disolución hay moléculas de ácido no disociadas.
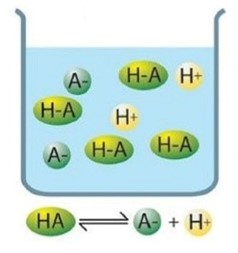
La constante de equilibrio tendrá la misma fórmula que para un ácido fuerte pero como la concentración de HA es muy grande, la Ka será muy pequeña y siempre menor que 1.
Aquí vemos ejemplos de ácidos fuertes y débiles y sus constantes de acidez.
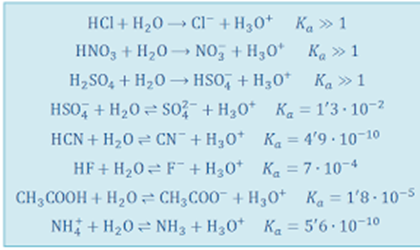
En general, los ácidos inorgánicos como el ácido clorhídrico, nítrico y sulfúrico son fuertes y los ácidos orgánicos son débiles.
Las bases
En general, la base o álcali es una sustancia que al disolverse en un medio acuoso libera iones hidroxilo (OH-) y presenta propiedades alcalinas.
Análogamente a los ácidos, las bases fuertes son aquellas que en agua están completamente disociadas.
![]()
Bases fuertes
a constante de equilibrio se denomina ahora constante de basicidad y es mayor que 1 para las bases fuertes

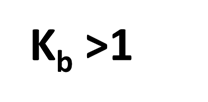
Bases débiles
Las bases débiles son aquellas que no están completamente disociadas, por lo tanto tienen una constante de basicidad menor que 1.
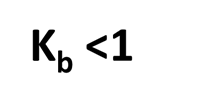
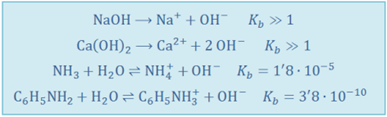
Ejemplos de bases fuertes y débiles
Bibliografía
Cambios en el equilibrio. Principio de Le Chatelier
