Desde las redes sociales nos han pedido que hablemos del pH de la piel, comentario que agradecemos y nos encanta. Hemos pensado empezar por recordar el concepto de pH, que puede estar olvidado o ser desconocido. Los siguientes artículos relacionados son «El manto ácido de la piel» y «Factores que afectan al pH de la piel«.
¿Qué sabemos del pH?

Si preguntamos a alguien qué mide el pH, la respuesta probablemente será si algo es ácido o básico. También sabrá seguramente que el pH del agua es 7 y que los ácidos tienen un pH inferior a 7 y las bases, superior. Y hasta aquí suele llegar la explicación.
Vamos a ampliar la explicación de qué es el pH y qué mide. Pero antes de empezar quería comentar por qué es tan importante el pH desde un punto de vista biológico.
Veamos simplemente un ejemplo: la mioglobina. Es una proteína que se encuentra en los músculos. Si observamos la curva de efectividad frente al pH, vemos que el máximo está a 6.
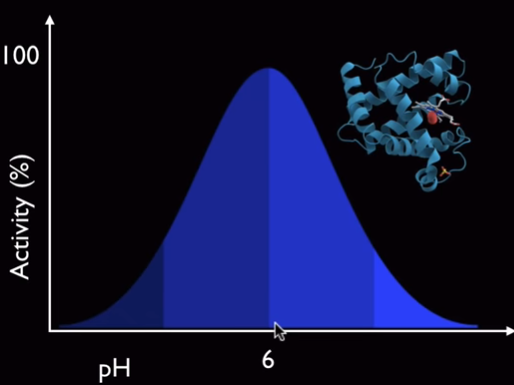
Curva de efectividad de la mioglobina frente al pH
La proteína será estable a pH entre 5 y 7, pero si salimos de ese intervalo, se desnaturaliza, pierde su actividad y nuestros músculos no funcionan. Por ello, es muy importante que los niveles de pH se mantengan constantes.
Estructura del agua
Empecemos hablando de la molécula de agua. Como seguramente recordáis, está formada por 2 átomos de hidrógeno y 1 de oxígeno, es decir, H2O.
Ahora, hay que entender algo muy importante. ¡La molécula de agua es polar! ¿Y eso qué significa? Los enlaces entre el oxígeno y cada hidrógeno son covalentes. Es decir, cada átomo aporta 1 electrón de los dos que forman el enlace y los comparten entre los dos.
No obstante, el oxígeno es mucho más ávido de electrones que el hidrógeno, por una cuestión de estructura. Por lo tanto, el par de electrones “compartido” está más desplazado hacia el oxígeno que hacia los hidrógenos.

El oxígeno atrae hacia sí los pares de electrones compartidos con cada hidrógeno
Esto genera un exceso de carga negativa sobre el oxígeno y de carga positiva sobre el hidrógeno. El exceso de carga se representa con la letra griega delta, δ. Estas densidades de carga son las responsables de que la molécula sea polar.
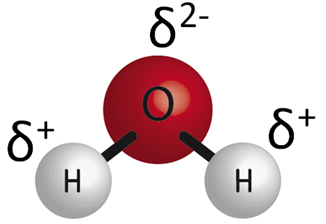
El resultado es una molécula con densidades de carga en cada uno de los átomos
Si ahora añadimos más moléculas de agua se organizarán de manera que los hidrógenos parcialmente positivos se enlazarán con los oxígenos parcialmente negativos. Este nuevo enlace se conoce como puente de hidrógeno.
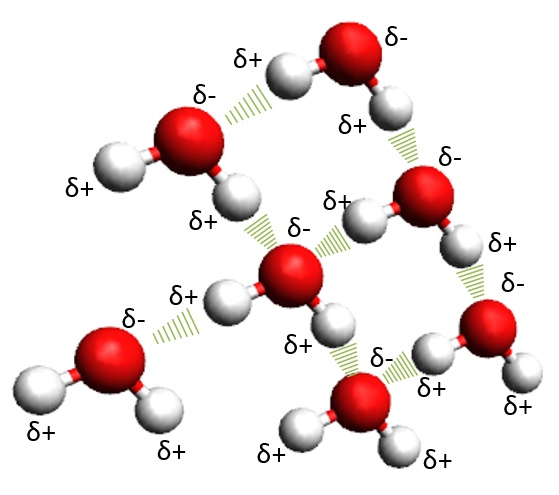
Enlaces por puente de hidrógeno entre las moléculas de agua
Así, al “desplazar” una molécula de agua, la molécula vecina vendrá con ella.
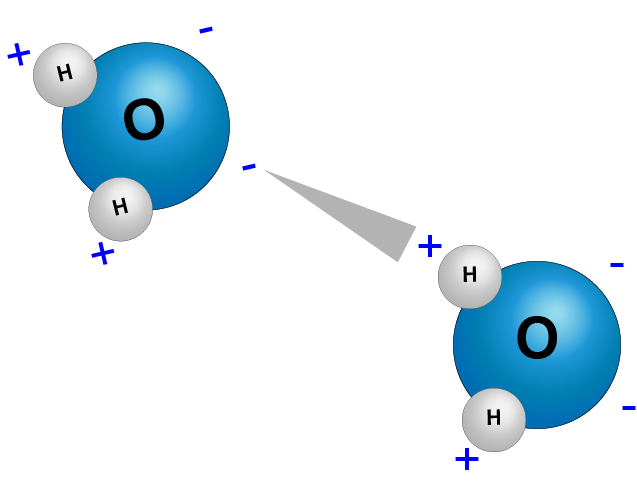
Las moléculas de agua se mueven juntas
Esto explica muchos fenómenos relacionados con la estructura del agua, como por ejemplo su alto punto de ebullición. Si no tuviera enlaces por puente de hidrógeno, el punto de ebullición sería mucho más bajo.

El agua hierve a 100ºC debido a los enlaces por puente de hidrógeno
Formación de iones hidronio e hidroxilo
Siguiendo con la atracción de las dos moléculas de agua, a veces sucede que la atracción es tan intensa que un átomo de hidrógeno se “desengancha” de una molécula de agua para “engancharse” en otra. Así se forman dos nuevas especies: el ion hidronio, H3O+, y el ion hidroxilo, OH–. En química se llaman iones a las especies cargadas positiva- o negativamente. Los iones hidronio son los responsables de la acidez y los hidroxilo, de la basicidad. Como en el agua ambas concentraciones son iguales, el agua es neutra.
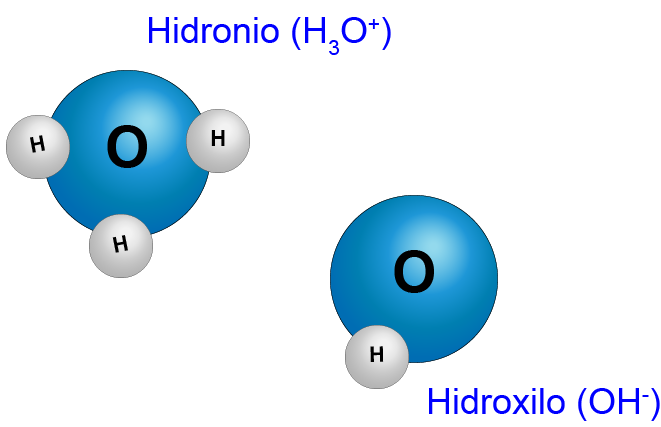
Formación de los iones hidronio e hidroxilo
En el sistema también quedan iones H+ –protones– libres que son equivalentes a los iones hidronio.
Ahora ya podemos definir el pH
Volvamos a nuestro tema inicial: ¿qué es el pH? La “p” se asocia a potencial y la “H” a hidrógeno. En otras palabras, el pH mide la cantidad de iones hidronio o de protones libres que hay en el agua o en una disolución.
En agua normal o destilada, la probabilidad de que se formen estos iones es realmente muy baja. Es del orden de 1 entre 10.000.000. Para que nos hagamos una idea, en la figura se ve la relación entre el volumen de 1 cubo y 1 millón de cubos.

No obstante, a pesar de ser una cifra tan pequeña, este hecho sucede y tiene mucha importancia en muchos procesos relacionados con el agua.
Ahora vamos a darle una forma matemática al pH para poder medirlo. La ecuación es:
pH = -log [H+] o bien pH = -log [H3O+]
ambas son equivalentes. Y aunque cueste creérselo, se utiliza para simplificar el uso del pH.
Pensemos en el valor de la división de 1 entre 10 millones
1/10.000.000 = 0,0000001
En notación científica se expresa como 10-7. Son cifras bastante incómodas para comunicarnos de forma habitual.
Sin embargo, si ahora ponemos en la calculadora: -log 10-7 ¡nos da como resultado 7! Cifra con la que ya es mucho más fácil trabajar, ¿a que sí?
pH = -log 10-7 = 7
7 es el valor del pH neutro, es decir cuando la concentración de H30+ y la de OH– es la misma. Un pH 7 implica que la concentración de iones hidronio es muy muy baja, como hemos visto.
¿Qué son los ácidos?
Un ácido que suele ser familiar es el ácido clorhídrico, HCl, que tenemos en nuestro estómago y gracias al cual hacemos la digestión.
Si añadimos HCl al agua, se disociará, es decir se separará en iones H3O+ y Cl–, aumentando la concentración de iones hidronio y formará una disolución.
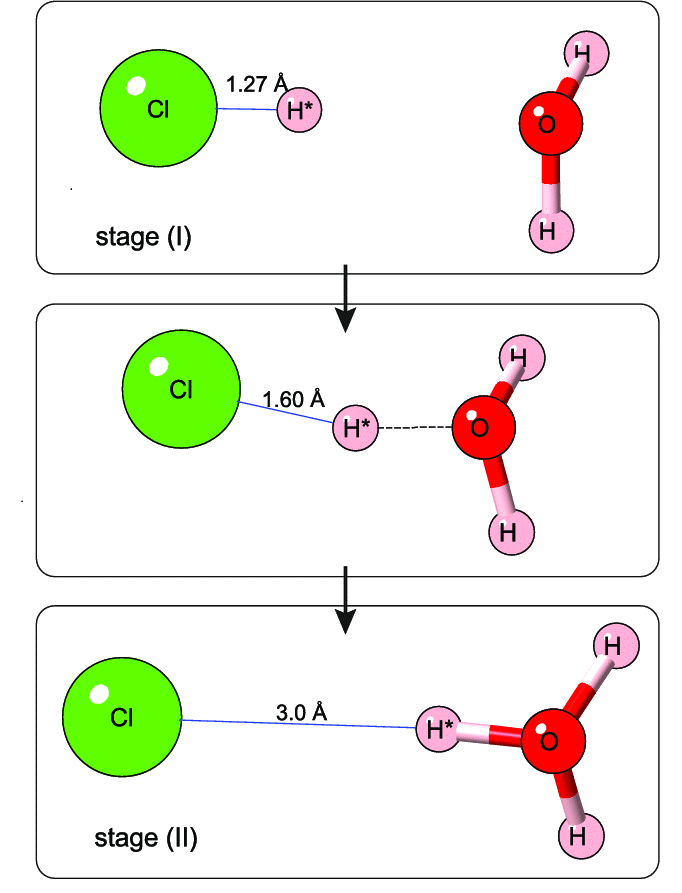
Disociación del ácido clorhídrico en agua
¿Qué sucederá con la concentración?
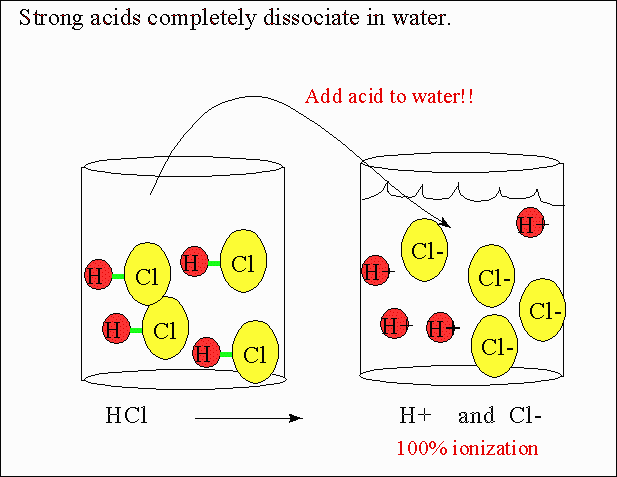
El ácido clorhídrico se disocia en Cl– y H+ formando una disolución
Ahora, la probabilidad de que se formen los iones, en lugar de ser 1 en 10.000.000, será de 1 en 100, lo que equivale a 10-2 en notación científica. Por lo tanto, el pH será 2:
pH = -log 10-2 = 2
Y dependiendo de la concentración del ácido clorhídrico podrá ser 1 ó 3.
Es decir, según hemos visto, cuanto mayor es la probabilidad de encontrar iones H+ en la disolución, menor es el pH y más ácida es.
¿Qué son las bases?
Tomemos como ejemplo la sosa, NaOH. ¿Qué sucederá cuando la añadamos al agua?
Se disociará también en sus iones Na+ y OH–:
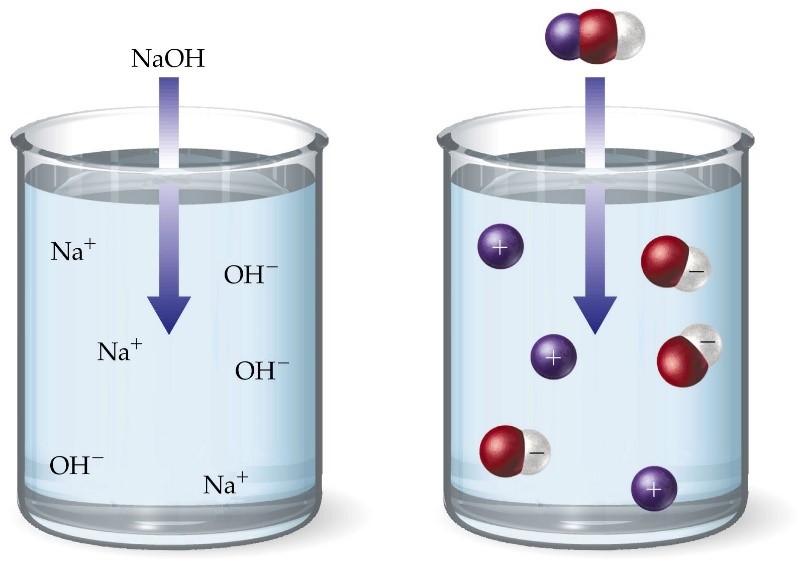
NaOH —-> Na+ + OH–
Esta ecuación no nos ayuda demasiado si recordamos que el pH mide la concentración de iones H+ en la disolución. Lo que sucede es que los iones OH- que provienen de la sosa reaccionan rápidamente con los iones H+ que ya teníamos. La probabilidad ahora de encontrar iones H+ libres es aún menor que en el agua tal cual que será de 1 en 1.000.000.000.000, es decir 10-12 y, por lo tanto, el pH será 12:
pH = -log 10-12 = 12
Es decir, el pH mide también la concentración de iones OH–.
Por lo tanto, cuanto menor es la probabilidad de encontrar iones H+ en la disolución o mayor la de encontrar iones OH–, mayor es el pH y más básica es.
Escala de pH
Indica la acidez o basicidad de diferentes disoluciones.
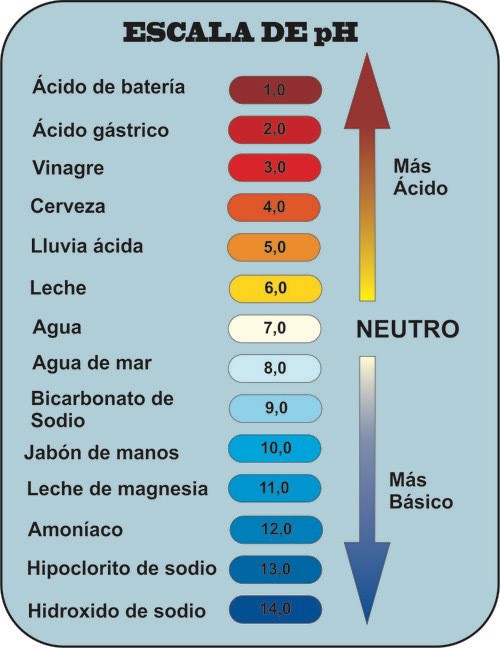
Y ahora ya sabemos porque si la disolución es neutra el pH es 7, si es básica es superior a 7 y si es ácida es inferior a 7.
Bibliografía
Quiero expresar mi agradecimiento a José Ángel Franca por la edición de algunas de las imágenes de este artículo.
