Hablamos de química y dibujos
Recuerdo una vez que estaba estudiando en la facultad con un gran libro de química orgánica entre las manos. Pasó un profesor por mi lado, se detuvo, se me quedó mirando y me dijo: “Así nunca aprenderás, la química orgánica se estudia dibujando, con un papel y un lápiz” ¡Y tenía razón!
Si yo hablo de E-1-(2,6,6-Trimetil-1-ciclohexa-1,3-dienil) but-2-en-1-ona, probablemente nadie se detendrá en el texto ni seguirá leyendo. No obstante, si dibujo:
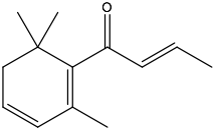
quizás en comprensión no habremos ganado mucho, de momento, pero sí en sencillez y también en estética y el interés aumentará un poco. Y con el tiempo veremos que está muy relacionado con esa maravillosa fragancia de las rosas.

Puesto que uno de los propósitos de OUSHIA es ser un espacio en el que compartir y difundir las razones químicas básicas que explican los efectos y reacciones que las sustancias naturales producen en nuestro cuerpo y en nuestro ánimo, recupero el consejo de aquel profesor mío y empiezo por el principio “dibujando” la Química.
Y es que los dibujos de las estructuras químicas tienen 3 ventajas importantes:
- Son mucho más fáciles de recordar que el nombre químico
- Permiten comprender mucho mejor sus propiedades y su comportamiento
- Y, la mejor noticia de todas: ¡son fáciles de interpretar!
¿Vamos a ello?
Empecemos por el principio: el átomo de Carbono -de símbolo C-.
Es el 15 elemento más abundante de la corteza terrestre y el segundo más abundante en el ser humano después del átomo de Oxígeno -de símbolo O-.
Si separamos un organismo vivo en sus compuestos básicos, encontraremos que un 70% es agua. El resto está formado por moléculas orgánicas, compuestas básicamente por combinaciones de C e Hidrógeno -de símbolo H-, que es el elemento químico más abundante en la Tierra.
Pero, ¿qué tiene de especial el C?, ¿por qué le llamo “átomo de la vida”?
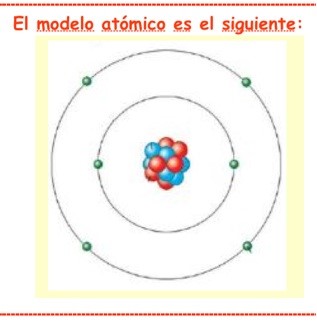
Pues porque tiene una gran habilidad para combinarse con otros átomos – y con él mismo especialmente-. Como todos los átomos, está formado por un núcleo, con protones -positivos- y neutrones -neutros- y una corteza con electrones -negativos-. El Carbono, al tener 4 electrones en la parte exterior de su corteza, puede combinarse hasta con 4 átomos a la vez y eso le otorga la posibilidad de formar infinitas combinaciones – las llamamos moléculas .
Actualmente existen más de 10 millones de moléculas orgánicas que son combinaciones del C con otros elementos: una parte son moléculas naturales, que se generan espontáneamente, y otras son moléculas preparadas en el laboratorio –como las que yo he preparado durante la mayor parte de mi vida profesional-.
Esta habilidad del C de enlazarse consigo mismo para formar diferentes compuestos lo hace ideal como base para generar “la química de la vida”. Se pueden formar cadenas increíblemente largas de C enlazados, que también pueden ramificarse o ciclarse o enredarse o formar hélices o …
¡Y ahora vamos a dibujarlo!
El C puede enlazarse con 4 átomos más, que normalmente suelen ser él mismo y el H. Estos enlaces los representamos por rayas como “ “ y al conjunto lo llamamos compuesto -o molécula-.
Así pues, el compuesto más básico que forman el C y el H es el CH4 , donde el subíndice 4 del H indica que el compuesto contiene 4 átomos de H y en el caso del C, al no tener ningún número, se acuerda que es 1 y se representa como:
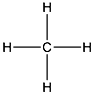
Éste compuesto es el gas metano -del griego methy, vino y el sufijo -ano-. Éste se considera un gas de efecto invernadero y se produce o bien de forma natural por descomposición de la materia orgánica en ausencia de oxígeno o bien lo genera el hombre por explotación de los combustibles fósiles o en las explotaciones agropecuarias y en los vertederos y forma parte del gas natural.

¡La importancia del metano!
El siguiente compuesto en orden de dificultad es el que tiene dos C enlazados entre sí, es el C2H6. El subíndice 2 indica que ahora el compuesto tiene 2 átomos de C y el 6 que tiene 6 átomos de H. Su representación es:
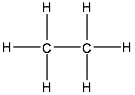
Y se trata ahora del gas etano – del griego aither éter y el sufijo -ano – y también es un excelente combustible.
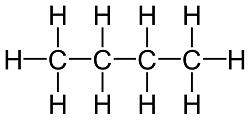
El siguiente es el C3H8, es decir, 3 C y 8 H:
Que es el gas propano, gas explosivo, que se utiliza principalmente como combustible.

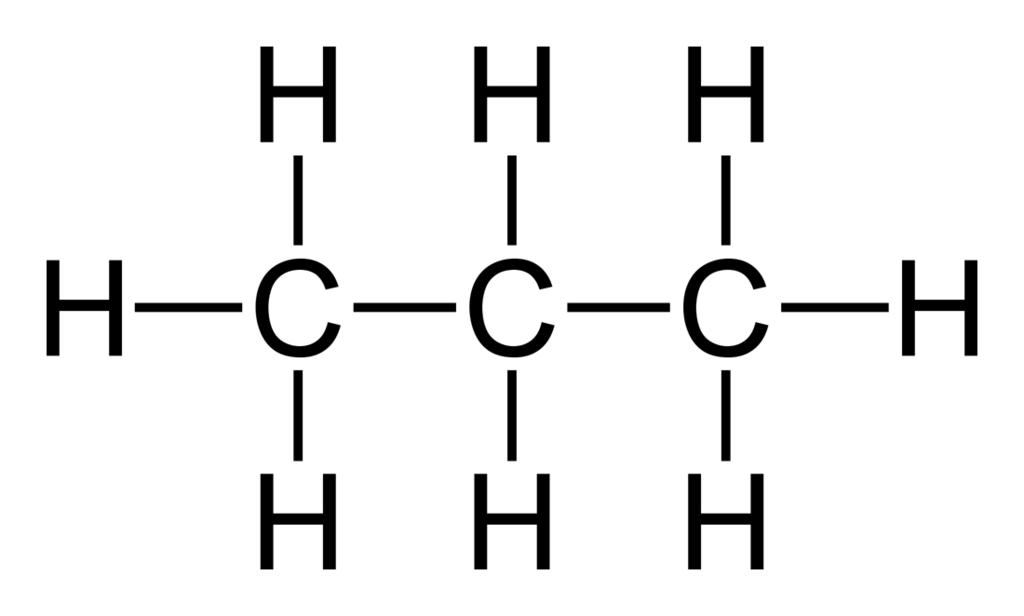
Y el siguiente, el C4H10:
¡El gas butano! Y ese ya lo conocemos todos…
¿Pero cada vez hay que dibujar TODOS los C y TODOS los H?
Así podríamos seguir indefinidamente, pero como cada vez se hace más tedioso dibujarlo, los químicos hemos adoptado una representación mucho más sencilla. Ahora vamos a pintar sólo las rayas que unen a los C pero sin los C y vamos a eliminar los H, porque ya se sobrentiende que el resto de enlaces que le faltan al C hasta llegar a 4 serán los H :
Entonces:
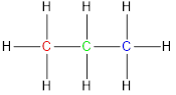
equivale a

O sencillamente:
![]()
Aquí vemos que la cadena de C ya no es recta si no que tiene forma de zig-zag. Esto es así debido a la estructura espacial del C, que en realidad no es plana, y es una característica muy importante de las cadenas carbonadas como iremos viendo más adelante.
Así, si la cadena es muy larga, por ejemplo, un C18H38:
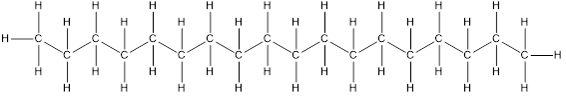
su representación simplificada se transformará en:
![]()
Mucho mejor ¿no?
Y de esta forma se nos van desvelando las moléculas esenciales de nuestra vida cotidiana…
¿Y estos dibujos son ayudarán a entender la química cotidiana?
Considero que hay muchos conceptos químicos que usamos frecuentemente, tales como: grasas trans, ácidos omega 3, grasas saturadas, insaturadas, hidrogenadas… y un montón de compuestos químicos que nos rodean continuamente, como los triglicéridos, parabenos, gluten, colesterol -bueno y malo-…, que en realidad no sabemos qué significan, simplemente aceptamos su nombre y los utilizamos con asiduidad.
Moléculas habituales de nuestra vida cotidiana
Uno de los objetivos de este espacio será precisamente desvelar, de forma comprensible, el significado de todos esos conceptos básicos tan relacionados con el cuidado saludable, no sólo desde un punto de vista alimenticio, si no también cosmético, puesto que una gran parte de los productos que nos ponemos sobre la piel acaban traspasándola y penetrando en nuestro interior.
La química es áspera, es cierto, pero muy gratificante cuando nos ayuda a comprender el mundo en el que vivimos. Quizá vale la pena hacer un pequeño esfuerzo de lectura al principio para dejar paso a la gran satisfacción de entender lo que nos rodea. ¿A quién no se le han puesto “los pelos de punta” cuando por fin ha comprendido algo que llevaba tiempo intentando comprender y por fin lo consigue? ¿No es ésa realmente una sensación maravillosa?
Y lo mejor de todo, ¡eso es posible en el caso de la química! Y los dibujos son la mejor herramienta.
