¿Has pensado alguna vez por qué es necesario un detergente para eliminar la suciedad? ¿O cómo actúa un detergente o un jabón? ¿Es la espuma una característica importante en la eficacia de un detergente? Veámoslo con detalle.

Proceso de limpieza de una superficie con un detergente
El proceso de limpieza de una superficie consta de tres fases, humectación, emulsión y aclarado.
Humectación
El agua por sí sola no es capaz de limpiar una superficie grasa. Al depositarse sobre la superficie, es repelida por ella y se forman gotículas. La superficie ni siquiera llega a mojarse.
¿Por qué? La tendencia de los líquidos a formar gotículas y de éstas a unirse con otras es lo que se conoce como tensión superficial.
La tensión superficial
Consideremos un vaso de agua. Dentro del vaso, las moléculas se agrupan porque están igualmente atraídas entre sí. No hay una fuerza neta en una dirección determinada. Pero las moléculas de la superficie, sin embargo, no tienen moléculas sobre ellas, por lo que se aferran firmemente a sus moléculas vecinas. El resultado es lo que se conoce como tensión superficial.
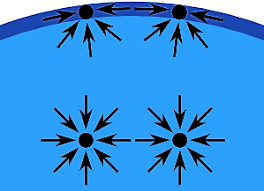
Efecto de la tensión superficial
Para que el agua pueda limpiar una superficie grasa, se debe poder extender sobre ella y conseguir mojarla. Para ello, la tensión superficial debe disminuir, es decir, hay que añadirle algo al agua que tenga efecto sobre su superficie.
La solución es un detergente. Cada molécula de detergente se compone de 2 partes: una formada por una cadena larga hidrocarbonada de naturaleza hidrofóbica -que odia el agua- y una pequeña cabeza polar cargada negativamente, de naturaleza hidrofílica -que ama el agua-. La parte hidrofílica es atraída por las moléculas de agua mientras que la parte hidrofóbica es repelida por el agua pero atraída por sustancias no polares como el aceite, la grasa o la suciedad.
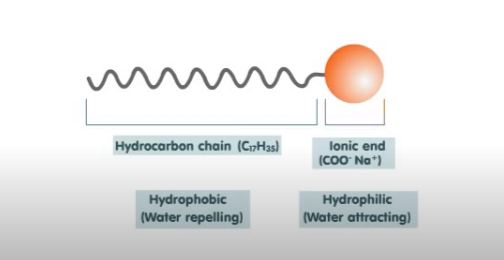
Estructura química de un detergente
Cuando se añade al agua, la parte hidrofílica tiende a disolverse y la parte hidrofóbica tiende a quedarse fuera del agua, manteniéndose en la superficie.
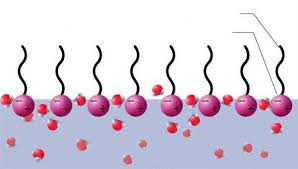
Disposición de las moléculas de detergente en el agua
Todas las moléculas intentarán situarse en la superficie de manera ordenada unas al lado de otras, intentando que la superficie sea más grande. La tensión superficial tiende a que la superficie sea más pequeña. El resultado final es que la tensión superficial se reduce.
El detergente reduce la tensión superficial del agua de modo que es capaz de extenderse y humectar realmente la superficie grasa.
Emulsificación
La suciedad en general tiene naturaleza aceitosa que el agua no puede disolver, por lo tanto, el agua no es capaz de eliminar la suciedad por sí misma y aquí es donde entra en acción el detergente.
Para entender su acción limpiadora observemos qué ocurre cuando lo añadimos al agua. Como acabamos de comentar, al principio se forma una monocapa de jabón con la parte no polar hidrocarbonada dirigida hacia el exterior del agua y la parte polar dirigida hacia el agua. Al agitar la solución, el detergente se disuelve completamente formando una emulsión.
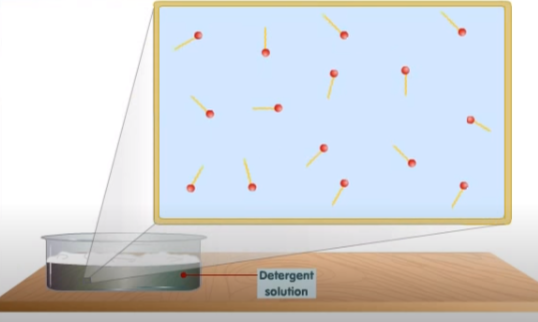
Disolución completa del detergente en agua
Al añadir una prenda de ropa sucia en esta solución, se produce un fenómeno muy interesante. Cuando las moléculas de detergente entran en contacto con la suciedad, la parte no polar de dichas moléculas queda atraída por la suciedad. Con el tiempo, más y más moléculas de detergente se acumulan alrededor de la suciedad, formándose una micela con la suciedad en su interior. Una micela es una bola de moléculas de detergente cuyos extremos hidrocarbonados -hidrófobos- están agrupados hacia el interior y sus cabezas polares dirigidas hacia el exterior.
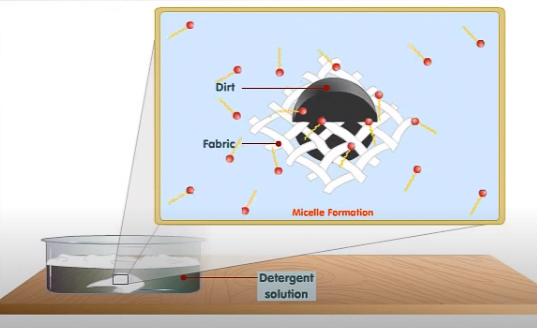
Moléculas de detergente formando una micela alrededor de la suciedad
Al agitar, las moléculas de suciedad se desprenden del tejido y quedan atrapadas en el centro de la micela. Después de repetidos aclarados, el tejido queda limpio.
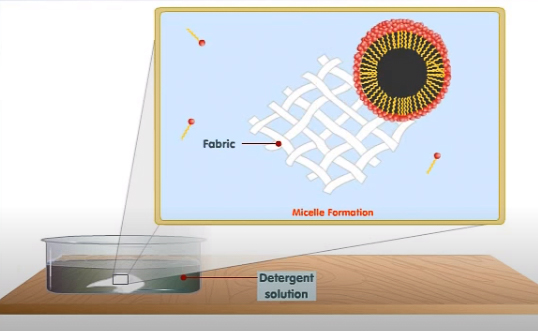
Micela con suciedad desprendiéndose del tejido
En este caso hemos tomado como ejemplo la limpieza de un tejido, pero el proceso es similar sobre cualquier otra superficie, como la piel o el cabello.
Aclarado
Al agitar el agua, estas micelas acaban desprendiéndose de la superficie de la ropa y pasan a la solución. Recordemos que debido a la carga de las cabezas de las moléculas de detergente, el exterior de la micela está también cargado. Y, como todas estas micelas tienen la misma carga, se repelen entre sí y permanecen suspendidas en el agua. Son eliminadas cuando se drena el agua. Después de repetidos aclarados, las micelas han desaparecido y la ropa queda limpia.
Proceso global
Puede resumirse en el siguiente esquema:
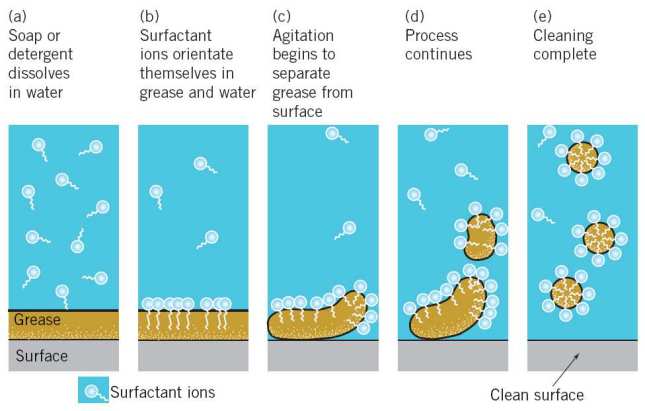
(a) El detergente se disuelve en el agua
(b) Las moléculas de detergente se orientan entre la grasa y el agua
(c) Al agitar la suciedad empieza a separarse de la superficie
(d) El proceso continua
(e) Las micelas de detergente encapsulando la suciedad se eliminan de la superficie dejándola limpia
La espuma
Todos sabemos que la mezcla de detergente, agua y aire produce espuma, pero ¿qué aporta realmente a la limpieza?
Curiosamente, hasta ahora ni la hemos mencionado. Y es que la espuma ejerce un pequeño o nulo papel en la acción limpiadora del detergente. Algunas veces llega a ser incluso indeseable. En la limpieza del suelo, en la lavadora de ropa o en el lavavajillas, el uso de un detergente excesivamente espumoso puede llegar a ser un grave inconveniente.

No obstante, en algunos casos puede llegar a tener su utilidad.
Como indicadora de la actividad remanente del detergente. Cuando todo el detergente se ha utilizado para emulsionar la grasa desaparece la espuma. Las moléculas de detergente salen de la espuma para emulsionar la grasa.
La espuma mantiene la acción limpiadora en la superficie. Cuando se mezcla con un detergente, la espuma permite que estas soluciones se asienten en las superficies durante más tiempo, lo que aumenta el tiempo de permanencia y ayuda a penetrar en la suciedad. Esta exposición adicional aumenta la efectividad del detergente. Es el caso del agua con jabón para limpiar la cara o el champú en la cabeza.

Como indicador psicológico del poder limpiador. Existe la creencia popularizada de que una espuma abundante significa mayor poder de limpieza. Frecuentemente resulta todo lo contrario. De un champú se espera que produzca gran cantidad de espuma. No obstante, si el champú tuviera la fuerza limpiadora proporcional a esa espuma, podría llegar a ser perjudicial para el acondicionamiento del cabello.
Bibliografía
https://anjungsainssmkss.wordpress.com/?s=cleansing
The Science of Cosmetics, John V. Simmons, MacMillan Press Ltd., Cosméticos: formulación, preparación y aplicación, A. Madrid Vicente, Ediciones
https://hotsycarlson.com/foam-clean-understanding-role-foaming-washing/
