Los ácidos grasos son las unidades básicas de la mayoría de aceites y grasas que forman parte de los seres vivos.

Tienen una estructura química determinada que vamos a explicar paso a paso en este artículo.
Es bastante frecuente que un cosmético natural contenga varios aceites vegetales en su formulación. Este es el primer artículo de una serie de 4 artículos destinados a la explicación detallada de la importancia que tiene la proporción relativa de los diferentes aceites vegetales en la formulación de cosméticos.
Los 4 artículos que veremos son:
1. ¿Qué son los ácidos grasos?
2. Ácidos grasos saturados e insaturados
3. Glicerina, la molécula que ordena los ácidos grasos
4. Importancia del perfil lipídico en la formulación de cosméticos
¿Cómo están constituidos los átomos?
Para empezar, recordemos brevemente que los átomos están formados por un núcleo en el que están los protones con carga positiva y los neutrones, sin carga. Y una periferia en la que están los electrones con carga negativa moviéndose alrededor.
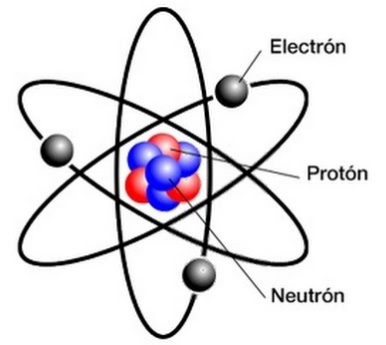
Estructura del átomo
La distribución de los electrones alrededor del núcleo no es aleatoria, se distribuyen en capas siguiendo unas leyes concretas. Los átomos tienen el mismo número de protones que de electrones, es decir, son eléctricamente neutros.
¿De qué elementos están formados?
Esta es la tabla periódica. En ella están todos los elementos -átomos- que existen en la Tierra. Está dividida en columnas verticales -grupos- y filas horizontales -períodos-. A medida que avanzamos hacia abajo en un grupo, los elementos son más grandes. Y a medida que avanzamos en un período, aumenta el número de electrones. Siguiendo los elementos de izquierda a derecha, cada uno tiene 1 electrón más que el anterior.
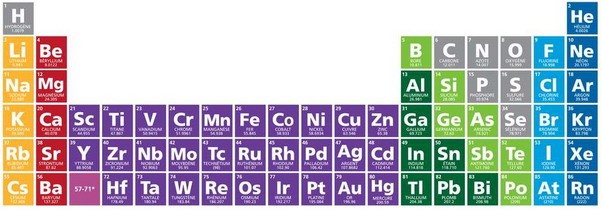
Tabla periódica de los elementos
De todos sus elementos vamos a fijarnos sólo en 3: carbono -C-, hidrógeno -H- y oxígeno -O-. La combinación entre ellos da lugar a infinidad de compuestos diferentes.
¿Qué hacen estos elementos para combinarse?
Fijémonos en el último grupo, el de más a la derecha. Está formado por los denominados gases nobles. Tienen en común que son muy poco reactivos, o dicho de otra manera, ¡que son muy estables! Y tienen algo más en común: todos ellos tienen 8 electrones en su última capa, excepto el helio -He- que sólo tiene 2 porque es más pequeño.

Los gases nobles
De aquí surge una de las primeras conclusiones importantes. Cuando se combinan los átomos para formar moléculas lo hacen de forma que acaban rodeados de 8 electrones en sus últimas capas. Y, en los compuestos que estamos estudiando, los ácidos grasos, lo consiguen compartiendo electrones entre sí.
Nuestros elementos escogidos: C, H y O
Volvamos ahora a nuestros átomos elegidos. El hidrógeno -H- es el más pequeño de todos los elementos de la tabla periódica. Sólo tiene 1 electrón -y, por lo tanto, 1 protón- y tiende a rodearse de 2 electrones, como su gas noble siguiente, el helio -He-.
El carbono -C- tiene 4 electrones en su última capa, es decir, le faltan 4 electrones para compartir. Y pueden ser de un átomo diferente, H o O, o de otro C.
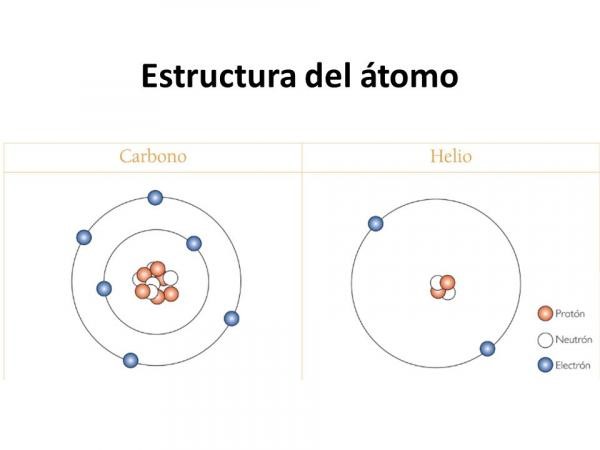
Estructura de los átomos de carbono y helio
El oxígeno -O- tiene 6, por lo que sólo necesita compartir otros 2.
¡Vamos a combinarlos!
Empecemos por uno sencillo. Representaremos los electrones por puntos azules y rojos para distinguir de qué átomo provienen, aunque en realidad, todos los electrones son iguales.
Así, tomamos 1 C y lo rodeamos de sus 4 electrones, puntos en azul. Añadimos 4 H, cada uno aportando su propio electrón, en rojo.
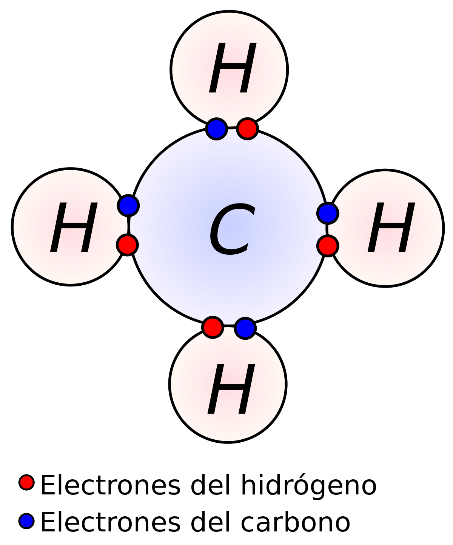
Representación electrónica de la molécula de metano
Nos queda esta estructura en la que el C está rodeado de 8 electrones y cada H de 2. ¡Exactamente lo que queríamos!
Metano
Esta estructura corresponde a un combustible muy conocido: el metano o gas natural.
A partir de ahora, como todos los electrones son iguales, sustituiremos los dos puntos por una raya. El metano quedará:
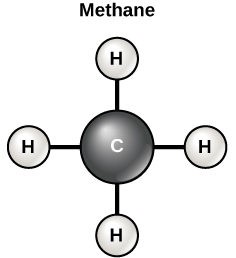
Molécula de metano
Su fórmula abreviada es CH4, indicando que 1 molécula de metano está formada por 1 átomo de C y 4 de H.
Etano
El carbono tiene una propiedad excepcional, puede enlazarse consigo mismo formando cadenas extremadamente largas. ¡Veámoslo! El siguiente compuesto de la serie es el formado por 2 C, el etano. Muy utilizado para producir otros productos derivados. Su estructura química es:
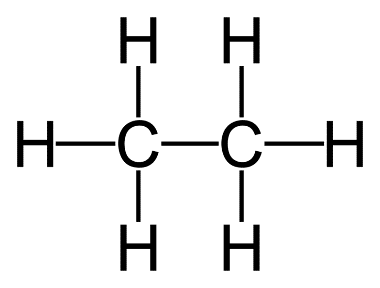
Molécula de etano
Vemos como aquí también cada C comparte 8 electrones y cada H, 2. Su fórmula abreviada es C2H6, indicando que 1 molécula de etano está formada por 2 átomos de C y 6 de H.
Propano
Si seguimos con la serie, el siguiente compuesto es el propano, uno de los principales combustibles:
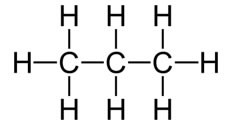
Molécula de propano
Su fórmula abreviada es C3H8, indicando que 1 molécula de propano está formada por 3 átomos de C y 8 de H.
Butano
El siguiente es el butano, del que no hace falta presentación:
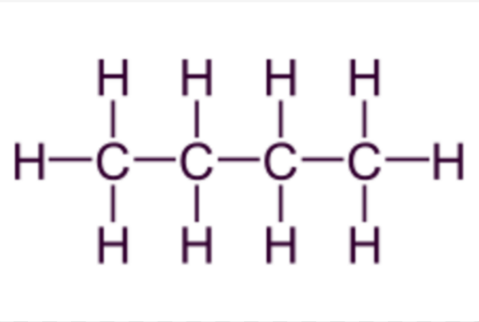
Estructura del butano
De fórmula abreviada C4H10, indicando que 1 molécula de butano está formada por 4 átomos de C y 10 de H.
Así podríamos seguir hasta formar cadenas de varias decenas de C con los correspondientes H. A estos compuestos se les conoce como hidrocarburos. Provienen del petróleo y son absolutamente insolubles en agua.
Una representación mucho más fácil
Como los químicos somos perezosos y nos gusta más dibujar que escribir, hemos simplificado estas estructuras representando simplemente el esqueleto carbonado. Cada vértice representa un carbono y los átomos de hidrógeno no se incluyen. Como ejemplos, fórmula esqueletal del hexano, C6H14, y del dodecano, C12H26.
Fórmula esqueletal del hexano
Fórmula esqueletal del dodecano
Ahora vamos a incluir al oxígeno
El oxígeno, aunque tiene 6 electrones en su última capa sólo comparte 2.
Tiene varias formas de combinarse con el C:
Formando alcoholes, como el metanol
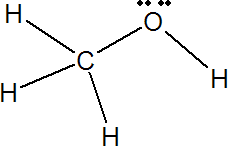
Estructura del metanol
Aquí vemos como el C y el O siguen rodeados de 8 electrones y los H de 2. El O sólo comparte 2 de sus electrones. La fórmula abreviada del metanol es CH3OH.
Formando aldehídos, como el formol
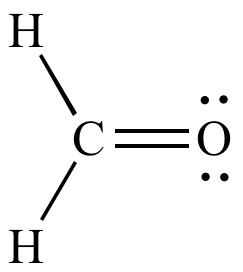
Estructura del formol
Y formando una estructura combinando ambos casos anteriores dando lugar a los ácidos, como el ácido acético del vinagre
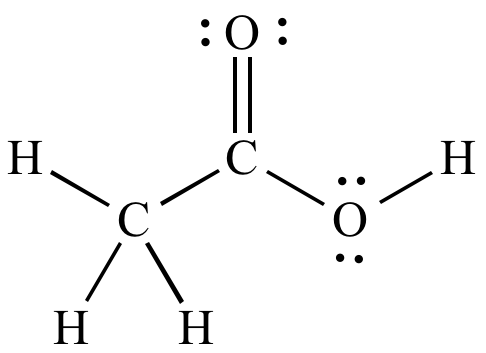
Estructura del ácido acético
La fórmula simplificada del ácido acético es CH3COOH.
Es decir, la función que corresponde a los ácidos orgánicos -que provienen del carbono- es -COOH.
¡Y ya tenemos los ácidos grasos!
Lo único que nos falta es añadirle esta función ácido a las cadenas carbonadas.
Por ejemplo, el ácido hexanoico, derivado del hexano, es:
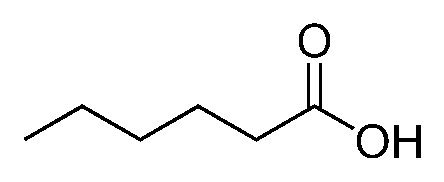
Fórmula del ácido hexanoico
Su fórmula simplificada es C5H11COOH, o bien CH3(CH2)4COOH.
O el ácido dodecanoico, derivado del dodecano, más conocido como ácido láurico, es:
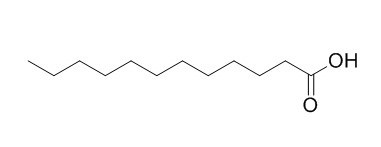
Fórmula del ácido láurico
De fórmula simplificada C11H23COOH, o bien CH3(CH2)10COOH
Los ácidos grasos pueden llegar a tener cadenas carbonadas de más de 30 átomos de carbono. Muchos de ellos tienen nombres específicos, como el ácido láurico que acabamos de ver. Es el componente principal del aceite de coco.
